В 1790 г. итальянский физиолог Луиджи Гальвани заметил, что лапка препарированной лягушки дергается, если к ней одновременно прикоснуться двумя инструментами из разных металлов. В то время уже было известно, что мышцы могут сокращаться под действием электрического тока, так, что Гальвани правильно приписал это явление действию электрического тока. Правда, он считал, что электрический ток появляется благодаря каким-то физиологическим процессам в лапке лягушки.
Правильное объяснение этому явлению смог дать другой итальянский ученый Алессандро Вольта. Он установил, что это явление связано с наличием двух разнородных металлов, соприкасающихся с электролитом, в роли которого выступала кровь лягушки, а сама лапка играла лишь роль чувствительного индикатора электрического тока [1]. Опираясь на свои исследования Вольта в 1799г. создал первый химический источник тока. В этом устройстве Вольта использовал медный и цинковый электроды, погруженные в раствор серной кислоты.
Цинк бурно реагирует с кислотами. В раствор переходят не атомы цинка, а положительные ионы, так что в электроде остается избыток электронов, следовательно, цинковая пластина заряжается отрицательно. Вообще, большинство металлов при погружении в электролит заряжается отрицательно, на поверхности медной пластинки протекает подобный процесс. Но избыток отрицательных зарядов на медном электроде гораздо меньше, а значит, относительно цинкового электрода его потенциал получается более высоким. Если соединить внешним проводником медную и цинковую пластины, то электроны начнут перемещаться с цинковой пластины на медную, т.е. в цепи потечет электрический ток [2].
Электрическое напряжение, возникающее между электродами, зависит от того, из каких металлов изготовлены электроды и от их взаимодействия с электролитом. Напряжение, даваемое элементом, никак не зависит от площади пластин.
Часто напряжения, даваемого одним гальваническим элементом, недостаточно. Тогда их можно соединять последовательно в батареи.
Вообще изготовить химический источник тока совсем нетрудно: надо поместить в электролит две пластинки из разных металлов [3]. Такие гальванические элементы возникают самопроизвольно. Например, намочил дождь крышу, покрытую оцинкованным железом, на железе наверняка имеются царапины, так, что и железо, и цинк вступили в контакт с водой, которая играет роль электролита. Цинк в такой паре начнёт активно разрушаться, а вот железо не пострадает, пока не разрушится весь цинк. Именно для этого и покрывают железо слоем цинка.
По той же самой причине скручивать вместе медные и алюминиевые провода, это, мягко говоря, не самая лучшая идея. В месте контакта начнется гальваническая коррозия, которая приведет к росту электрического сопротивления контакта, что в свою очередь приведет к большему выделению тепла и еще более быстрой коррозии. Все вместе это может стать причиной разрушения соединения и даже пожара.
Нагляднее всего можно пронаблюдать гальваническую коррозию на примере контактов железа с цинком и медью в растворе соли. Железные скрепки были надеты на цинковую и медную пластины и погружены в раствор соли.
Через сутки скрепка, соединенная с медной пластиной, покрылась ржавчиной. В то время, как скрепка, бывшая в контакте с цинком, совершенно не пострадала.
Ученые составили электрохимический ряд напряжений металлов. Чем дальше друг от друга отстоят металлы в этом ряду, тем более высокое напряжение дает гальванический элемент, составленный из этих металлов. Так пара золото – литий теоретически может дать электродвижущую силу (ЭДС) 4,72 В. Но такая пара в водной среде работать не сможет – литий это щелочной металл, легко реагирующий с водой, а золото стоит слишком дорого для подобного применения.
На практике элемент Вольта обладает рядом серьёзных недостатков.
- Во-первых, электролитом ему служит весьма едкая жидкость – раствор серной кислоты. Жидкий электролит всегда представляет собой неудобство или даже опасность. Он может расплескаться, разлиться при повреждении корпуса.
- Во-вторых, на медном электроде такого элемента будет выделяться водород. Это явление называется поляризацией. По многим свойствам водород весьма близок к металлам, так что его пузырьки создадут дополнительную ЭДС поляризации, стремящейся вызвать ток противоположного направления [2]. Кроме того, пузырьки газа не пропускают электрический ток, что тоже ведет к ослаблению тока. Поэтому приходится периодически встряхивать сосуд, удаляя пузырьки механически, или вводя в состав электролита специальные деполяризаторы.
- В третьих, в процессе работы гальванического элемента Вольта, цинковый электрод постепенно растворяется. Теоретически, когда гальванический элемент не используют, разрушение цинкового электрода должно прекратиться, но поскольку почти всегда в составе цинка есть примеси других металлов, они при соприкосновении с электролитом играют роль второго электрода, образуя короткозамкнутый элемент, что ведет к гальванической коррозии цинкового электрода [2]. Для того, чтобы устранить этот недостаток, приходится использовать сверхчистый цинк или конструктивно предусматривать возможность извлечения цинкового электрода из электролита. Так что когда батарея не используется, электролит из нее следует сливать.
Но для демонстрационных целей всеми этими недостатками можно пренебречь, если заменить серную кислоту более безопасным электролитом.
Источник токов
Существует два типа электрохимических элементов: гальванические и электролитические. Гальваническая клетка использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции для выработки электроэнергии.
Электролитическая ячейка потребляет энергию от внешнего источника, используя ее, чтобы вызвать непредвиденную окислительно-восстановительную реакцию.
Два типа ячеек
Гальванический элемент, история создания которого официально началась в 18 веке, дал старт развития науки электротехники. Во время проведения экспериментов с электричеством в 1749 году Бенджамин Франклин впервые ввел термин «батарея» для описания связанных конденсаторов. Однако его устройство не стала первой ячейкой. Находки археологов «батареи Багдада» в 1936 году имеют возраст более 2000 лет, хотя точное назначение их до сих пор спорно.
Луиджи Гальвани в честь которого названа гальваническая ячейка, впервые описал «электричество животных» в 1780 году, когда пропускал ток через лягушку. В то время он не знал об этом, но его устройство работало по принципу батареи. Его современник Алессандро Вольта в честь которого названа «вольтовая ячейка» был убежден, что «животное электричество» исходило не от лягушки, а от чего-то другого, он много работал над этим и в 1800 году изобрел первую настоящую батарею — «вольтовую кучу».
Александро Вольт
В 1836 году Джон Фредерик Даниэль, исследуя способы преодоления проблем вольтовой кучи создал свою ячейку. За этим открытием последовало создание ячейки Уильяма Роберта Гроува в 1844 году. Первая аккумуляторная батарея была изготовлена из свинцово-кислотного элемента в 1859 году компанией Gaston Plante, далее появились гравитационная ячейка Калло в 1860 и ячейка Лекланш Жоржа Лекланша в 1866 году.
До этого момента все батареи были мокрого типа. В 1887 году Карл Гасснер создал первую сухую батарею, изготовленную из углеродно-цинковой батареи. Никель-кадмиевая батарея была представлена в 1899 году Вальдмаром Юнгнером вместе с никель-железной батареей. Однако Юнгнер не смог запатентовать ее и в 1903 году изобретатель Томас Эдисон запатентовал свой слегка измененный дизайн.
Русский ученый-физик Василий Петров в 1802 году соорудил крупнейшую гальваническую батарею в мире, дающую напряжение 1500В. Для сооружения потребовалось около 4200 цилиндров из меди и цинка с диаметром 35.0 мм м толщиной 2.5 мм. Батарея была размещена в ящике из красного дерева, обработанного несколькими слоями различных смол. Опыты Петрова положили начало современной электрометаллургии в дуговых печах.
Обратите внимание! Крупный прорыв в гальваническом направлении источников тока произошел в 1955 году, когда Льюис Урри, сотрудник , представил общую щелочную батарею. 1970-е годы привели к никель-водородной батарее, а 1980-е годы к никель-металлогидридной батарее
Литиевые батареи были впервые созданы еще в 1912 году, однако наиболее успешный тип, литий-ионный полимерный аккумулятор, используемый сегодня в большинстве портативных электронных устройств, был выпущен только в 1996 году.
Способ второй: банка с электролитом
Для сборки своими руками устройства, похожего по конструкции на первую батарейку в мире, понадобится стеклянная банка или стакан. Для материала электродов используем цинк или алюминий (анод) и медь (катод). Для увеличения эффективности элемента их площадь должна быть максимально большой. Провода лучше будет припаять, но к электроду из алюминия провод придется прикрепить заклепкой или болтовым соединением, так как паять его сложно.
Электроды погружаются внутрь банки так, чтобы они не соприкасались друг с другом, и концы их находились выше уровня банки. Лучше их зафиксировать, установив распорку или крышку с прорезями. Для электролита используем водный раствор нашатыря (50 г на 100 мл воды). Водный раствор аммиака (нашатырный спирт) – это не тот нашатырь, который используется для нашего опыта. Нашатырь (хлористый аммоний) – это порошок без запаха белого цвета, применяющийся при пайке в качестве флюса или как удобрение.
https://youtube.com/watch?v=yeWnPoQ3cSY
Второй вариант приготовления электролита – сделать 20% раствор серной кислоты. При этом нужно заливать кислоту в воду, и ни в коем случае не наоборот. Иначе вода мгновенно закипит и ее брызги вместе с кислотой попадут на одежду, лицо и глаза.
Осталось налить получившийся раствор в банку так, чтобы до краев сосуда оставалось не менее 2 мм свободного пространства. Затем при помощи тестера подобрать необходимое количество банок.
Собранный своими руками элемент питания похож по составу на солевую батарейку, так как содержит хлорид аммония и цинк.
Гальванопластика своими руками
Установку для гальванопластики в домашних условиях собрать несложно, оборудование и материалы для электрохимического осаждения меди находятся в свободном доступе. Исключение составляет серная кислота, приобретение и использование которой возможно только организацией, имеющей специальное разрешение.
В продаже есть готовые наборы для гальваники, но их покупка не всегда будет оправдана – гораздо дешевле собрать установку самостоятельно, используя доступное оборудование.
С помощью гальванической установки, о которой мы расскажем в данной статье, вы сможете получать копии художественных изделий, вне зависимости от материала из которого они изготовлены, а также имея навыки лепки из пластилина или глины, воспроизводить собственные произведения в металле.
Кроме этого, с помощью метода гальванопластики можно реализовать множество интересных проектов, например, проводить металлизацию плетеных или вязанных кружев для изготовления ажурных композиций, изготавливать металлические гербарии из цветов и листьев, металлизировать фрукты, производить отделку изделий из стекла или фарфора, наращивая слой меди по ранее заданному рисунку, и многое другое.
Гальванопластика может быть отличным выбором не только в качестве интересного хобби, но и при правильном подходе и упорстве стать фундаментом для будущего бизнеса.
Оборудование для гальванопластики в домашних условиях
Гальваническое осаждение меди в домашних условиях проводят в емкостях любой геометрической формы. Размер гальванической емкости зависит от размера будущих изделий или репродуцируемых композиций. Материал может быть различным, подойдут емкости из стекла, керамики или пластмассы.
Вторым ключевым элементом гальванической установки является источник постоянного тока. Для проведения работ используют ток низкого напряжения в пределах 3-6 В. Можно использовать аккумулятор, или выпрямитель. Для измерения силы тока потребуется амперметр, для фиксации напряжения — вольтметр.
Для размещения формы и анодов в гальванической емкости необходимо предусмотреть подвесы. Форма подвешивается на проволоке из меди или латуни и помещается в емкость на расстоянии 15-20 мм от анода.
Электроды, соединенные с положительной клеммой источника тока (анодом) подвешиваются также на меди или латуни, при этом проволочные крючки не погружают в электролит, в противном случае возможна деформация подвесов из-за разъедания крючка. Форма подключается к отрицательной клемме источника тока.
В качестве анодов используют медные пластины толщиной от 3 мм. достаточных размеров. Площадь поверхности анодов должна превышать площадь поверхности формы.
Для контроля температуры электролита можно использовать обычный ртутный термометр.
Приготовления электролита для гальванопластики
медного купороса в растворе – 150-180 г/л. Порошок медного купороса растворяют в горячей воде и, после охлаждения и фильтрации, в него осторожно, небольшими порциями вливают серную кислоту из расчета 30-35 г/л.
Если содержание медного купороса в растворе превышено, сульфат меди начинает кристаллизоваться на стенках гальванической емкости и на аноде, в этом случае необходимо, провести анализ электролита (см.
«Анализ и корректировка электролита меднения») и, по результатам, добавить воды или кислоты.
Избыток серной кислоты в электролите может привести к тому, что осадки меди получатся хрупкие, непрочные. Недостаток кислоты вызывает осаждение рыхлого и пористого слоя.
Для повышения качества получаемых осадков меди, специалисты советуют добавить в электролит спирт в количестве 8-10 г/л. Спирт в небольшом количестве улучшает структуру покрытия, делает медь мелкокристаллической, более твердой и упругой.
На качество электролита и получаемого медного осадка может оказывать негативное влияние возможное наличие в растворе органических примесей. Для их устранения в подогретый раствор добавляют 2-3 г/л перманганата калия или такое-же количество измельченного активированного угля. После охлаждения до 18-200С и фильтрации раствор можно использовать.
При интенсивном использовании электролит необходимо фильтровать для удаления шлама — порошкообразной меди, графита и пыли.
Шлам постепенно накапливается в растворе, оседает на дне и стенках емкости, мелкодисперсные частицы образуют взвесь, которая может загрязнять получаемые осадки меди.
На количество шлама влияет качество меди, использованной при изготовлении анодов, а также повышенная плотность тока в процессе.
В статье Анализ и корректировка электролита меднения рассмотрены метод определения содержания медного купороса и серной кислоты в растворе электролита, а также приведен расчет количества компонентов.
Процесс гальванопластики
Температура электролита в процессе гальванического осаждения меди составляет 18-200С и может повышаться до 280С за счет выделения тепла в процессе электролиза.
Начинают процесс при минимальной плотности тока, которую поддерживают до формирования слоя металла на поверхности. Рабочая плотность тока выставляется, только после того, как слой металла закрыл подключенные проводники.
Максимальная плотность тока в процессе зависит от толщины проводников, которая в свою очередь зависит от размера будущей композиции и материала формы.
В любом случае, чем выше плотность тока, тем интенсивней процесс металлизации.
Особенности процесса лучше разобрать на конкретных примерах использования метода гальванопластики в домашних условиях.
Копирование барельефов, чеканок, медалей, глиняных и пластилиновых изделий
Для снятия копий с подобных предметов используют гипсовые формы. Изготавливается гипсовая форма просто:
- в воде разводят гипс до получения сметанообразной массы;
- поверхность копируемого предмета смазывают раствором парафина в керосине (для легкого демонтажа формы после затвердевания гипса);
- кистью наносят тонкий слой гипса на поверхность изделия (для предотвращения образования пор);
- вокруг формы устанавливают бортик (для предотвращения растекания гипса);
- заливают поверхность изделия гипсом (гипс быстро схватывается, поэтому делают это быстро);
- извлекают форму после высыхания гипса;
- подключают к форме проводники и устанавливаю ее в гальванической ванне (см. Что такое гальванопластика. Подключение форм к источнику тока).
Металлизация кружев
Металлизация кружевных композиций — это интересный прием гальванопластики, при котором слоем металла покрывают плетенные или вязанные кружева, тюлевые кружева и другие композиции, изготовленные из нитей. Такие изделия могут выполнять роль декорирующих элементов различных художественных композиций, или применяться непосредственно для изготовления таких композиций.
Медь быстро темнеет на воздухе поэтому, как правило, металлизированные медью кружевные композиции дополнительно покрывают тонким слоем драгоценного металла методом гальваники. Гальваническое серебрение или золочение проводится в обычном режиме.
Изготовление металлической кружевной композиции происходит следующим образом:
- кружева растягивают и крепят на рамке из проволоки (изолированной) или дерева;
- пропитывают материал восковой композицией для гальванопластики;
- помещают материал между двумя листами бумаги и проглаживают утюгом для удаления излишков воска;
- наносят электропроводящий слой – мелкодисперсный графит или токопроводящий состав;
- подключают тонкие медные проводники и устанавливают рамку в гальваническую емкость.
- материал, покрытый слоем меди, извлекают из электролита, снимают с рамки и придают необходимую форму или монтируют на декорируемом изделии.
- Наращенный слой меди покрывают слоем серебра (гальваническое серебрение) или оксидируют (см. статью Серебрение в домашних условиях).
Изготовление металлических листьев или гербариев
Металлизация древесных листьев, не отличается от других приемов гальванопластики за исключением способа получения формы. Отпечаток с листа можно получить на восковой композиции.
Нагретый воск заливают в предварительно изготовленную обечайку, с невысокими бортиками и дают ему остыть до момента, когда поверхность восковой композиции затвердеет, но останется эластичной.
Лист кладут на поверхность воска и прижимают стеклом. После чего стекло снимают вместе с листом. На поверхности восковой композиции должен остаться четкий отпечаток листа.
Подобным образом делают отпечаток обратной стороны листа.
После полного остывания воска, мягкой кистью аккуратно наносят мелкодисперсный графит, подключают медные проводники, устанавливают грузики и помещают форму в гальваническую емкость.
Дальнейшая работа с металлическим отпечатком листа, это творческий процесс. В результате должен получится металлический лист, повторяющий форму образца и в точности копирующий его поверхность.
Покрытие медью изделий из дерева
Небольшие деревянные элементы декора покрывают слоем металла для придания им вида литых изделий.
Перед тем, как нанести слой токопроводящего вещества (графита) деревянные изделия пропитывают (проваривают) в восковой смеси, парафине, церезине или озокерите.
В противном случае, из-за своей гигроскопичности дерево будет впитывать электролит. Затем на изделия наносят графит, подсоединяют проводники, грузы и опускают в электролит.
Процесс ничем не отличается от металлизации гипсовых композиций.
Металлизация перьев птиц
Перья птиц погружают в расплавленную восковую композицию, парафин, церезин или озокерит, затем графитируют, прикрепляют тонкий медный провод, подвешивают груз и опускают в электролит.
Металлизация фруктов, растений и цветов
Для покрытия металлом растений и фруктов потребуется предварительно покрыть их тонким слоем серебра. Для этого растения сушат, обрабатывают спиртом или раствором хлорида натрия, бария или кальция. Потом готовят растворы:
- Гидроксид натрия 4 г на 100 мл дистиллированной воды.
- Нитрат серебра 4 г на 100 мл воды.
- Аммиак 7 г на 100 мл воды.
- Сахар 2,5 г на 85 мл воды.
Затем растворы вливают в емкость и погружают в раствор растение. Поверхность покрывается тонким слоем серебра (химическое серебрение). Затем растение или фрукт подвергают гальваническому меднению.
Описанные в статье способы металлизации различных изделий и форм являются примером применения методов гальванопластики в домашних условиях и условиях художественной мастерской.
Процессы гальванического меднения подробно описаны в статьях: Гальваника в домашних условиях, Меднение и могут быть применены к изделиям, изготовленным из различных материалов, в том числе из диэлектриков, с нанесенным токопроводным слоем.
Щелочная (алкалиновая) батарейка
Щелочной диоксид цинка-марганца или ”щелочной” гальванический элемент батарейка обеспечивает гораздо более высокую плотность энергии и, следовательно, емкость, чем углерод-цинковый или марганцево-цинковый-хлоридный тип. Она также способна к более высокому разрядному току.
Диоксид марганца (MnO2) и углерод образуют положительный электрод, в то время как цинк находится в порошкообразной форме, как отрицательный электрод (анод), который фактически смешивается с образованием геля/пасты с гидроксидом калия (KOH) с цинковым порошком в качестве электролита. Несмотря на то, что щелочная батарея дороже и несколько тяжелее, она превосходит углерод-цинковые или хлоридные типы. Кроме того, щелочные батареи, как известно, долговечны из-за их способности избегать коррозионного воздействия из-за кислого иона аммония на цинк. Щелочные гальванические элементы батарейки особенно подходят для применений, которые включают в себя сравнительно высокие уровни тока разряда.
Способ первый: батарейка из лимона
Эта самодельная батарейка будет использовать электролит на основе лимонной кислоты, содержащаяся в мякоти лимона. Для электродов возьмем медную и железную проволочки, гвозди или булавки. Положительным будет медный электрод, а отрицательным – железный.
Лимон нужно разрезать поперек на две части. Для большей устойчивости половинки кладутся в небольшие емкости (стаканы или рюмки). Необходимо присоединить провода к электродам и погрузить их в лимон на расстоянии 0,5 – 1 см.
Теперь нужно взять мультиметр и измерить напряжение на получившемся гальваническом элементе. Если его недостаточно, то потребуется еще изготовить своими руками несколько одинаковых лимонных батареек и соединить их последовательно с помощью тех же проводов.
Самодельная батарейка из подручных средств
Батарейка или гальванический элемент – это химический источник электрического тока. Все батарейки, продающиеся в магазинах, по сути, имеют одинаковую конструкцию. В них используются два электрода из разного состава. Основным элементом для отрицательного вывода (анода) солевых и щелочных батареек является цинк, а для их положительного (катода) – марганец. Катод литиевых батареек изготавливается из лития, а для анода используются самые различные материалы.
Между электродами батареек расположен электролит. Состав его различен: для солевых батареек, имеющих самый низкий ресурс, используется хлорид аммония. Для изготовления щелочных батареек применяют гидроксид калия, а в литиевых батарейках используется органический электролит.
https://youtube.com/watch?v=chfVwKF5R1A
При взаимодействии электролита с анодом вблизи него образуется избыток электронов, создающий разность потенциалов между электродами. При замыкании электрической цепи количество электронов за счет химической реакции постоянно пополняется, и батарейка поддерживает протекание тока через нагрузку. При этом материал анода постепенно коррозирует и разрушается. При полной его выработке ресурс батарейки оказывается исчерпан.
Несмотря на то, что состав батареек сбалансирован производителями для обеспечения долгой и стабильной их работы, изготовить элемент питания можно и самому. Рассмотрим несколько способов, как можно сделать батарейку своими руками.
Делаем аккумулятор
А теперь решим вопрос, как сделать аккумуляторную батарею своими руками в домашних условиях. Точнее, пока не батарею, а единичный аккумулятор. Начнём с самой интересной по принципу работы конструкции — газового аккумулятора. Чтобы собрать такой источник тока, нам понадобятся:
- два угольных стержня;
- активированный уголь;
- непрозрачная ёмкость;
- хлопковая ткань;
- иголка с ниткой;
- поваренная соль.
Угольные стержни можно добыть из солевых батареек, причём подойдут и отслужившие свой срок. Активированный уголь продаётся в аптеках в таблетках. В качестве непрозрачной ёмкости подойдёт пластиковый стаканчик, окрашенный или оклеенный непрозрачной бумагой.
В отличие от гальванических элементов, оба электрода в газовых аккумуляторах выполнены из одинаковых материалов и имеют одинаковую конструкцию. Но перейдём к делу. Начнём с добычи электродов. Лучше брать солевые батарейки типоразмера D — там стержни больше. Достать из них графит будет нетрудно. Развальцовываем верхний бортик верхней части батарейки, поддеваем металлическую крышку шилом и снимаем её. Под крышкой пластиковая прокладка. Шилом снимаем и её.
Видим графитовый стержень, воткнутый в чёрную плотную массу. Расковыриваем шилом массу и вынимаем стержень.
Теперь берём два добытых графитовых стержня, тем или иным способом прикрепляем к их концам провода — это будут токовыводы. Шьём из Х/Б ткани два мешочка такого размера, чтобы в них вошло примерно по 80–100 граммов порошкообразного активированного угля.
Настал черёд угля. Продаётся он в виде таблеток, нам он нужен в порошке. Долго и упорно толчём таблетки в ступке, пока не получится очень мелкая пыль. Насыпаем её в мешочки, вставляем угольные стержни, подтрамбовываем, если нужно, подсыпаем. Зашиваем наши мешочки как можно тщательнее и плотно обматываем нитками. Чем лучше обмотаем, тем лучшим будет контакт угля с графитовым стержнем.
Устанавливаем электроды в стаканчик и разделяем их каким-либо сепаратором. На фото ниже в качестве сепаратора использована обычная щепка, но лучше сделать что-то более ионопроницаемое. К примеру, толстый ватин.
Электроды на месте, электролит готов
Заливаем электролит (100 г соли на 1 л воды), но не доверху — контакты должны остаться сухими. Аккумулятор готов, но его ещё нужно зарядить. Поскольку электроды у нас одинаковые, произвольно выбираем, какой будет плюсовым, какой минусовым. Можно приступать к зарядке. Для этого понадобится источник постоянного тока с напряжением 4,5–5 В. Подойдёт, к примеру, зарядное устройство от любого пятивольтового гаджета. Подключаем его к клеммам и начинаем зарядку.
Полезно! Перед зарядкой лучше выждать 10–15 минут, чтобы уголь в мешочках как следует пропитался.
В процессе зарядки начинается электролиз электролита (натрия хлорид + вода). В результате электролиза на одном из электродов накапливается водород, на другом — хлор. Запасается он в порах активированного угля в чистом виде и ни с чем не взаимодействует. Как только «контейнеры» будут заполнены, начнётся бурное выделение газов (аккумулятор «закипит», поскольку водороду и хлору негде больше накапливаться). Напряжение к тому времени на клеммах аккумулятора станет равным 2,2–2,4 В.
При таких габаритах наша перезаряжаемая батарейка будет иметь ёмкость примерно 1 А·ч, а ток короткого замыкания составит примерно 300 мА. По мере разряда напряжение будет снижаться, пока не упадёт до нуля — устройство не боится полного разряда. А при желании его можно даже переполюсовать, зарядив наоборот. Пока мы будем разряжать аккумулятор, газы будут покидать электроды, восстанавливая соль и воду. В чём недостатки газовых аккумуляторов? Основной — большой саморазряд. Даже если нагрузка полностью отключена, электроды будут терять газ, и буквально через пару дней источник снова придётся заряжать.
Мнение эксперта
Алексей Бартош
Специалист по ремонту, обслуживанию электрооборудования и промышленной электроники.
Задать вопрос
Важно! Чтобы уменьшить саморазряд, необходимо полностью защитить электроды от света — взять непрозрачный корпус и сделать светонепроницаемую крышку.
Теперь о свинцовых аккумуляторах. Хороших показателей от аккумулятора такого типа (как и от щелочного), конечно, добиться можно. Но процесс изготовления свинцовой батареи большой ёмкости настолько затратный и трудоёмкий, что заниматься изготовлением источника тока этого типа не имеет смысла. Поэтому мы не станем возиться с изготовлением свинцового аккумулятора, а просто посмотрим занимательное видео. И если будет желание, каждый сможет повторить этот эксперимент самостоятельно.
Самодельный свинцово-медный аккумулятор
Вроде всё просто, но, как видим, результаты неутешительные. А самому лить пластины, наносить на них оксид и диоксид свинца, как было замечено выше, смысла нет.
Способ четвертый: батарейка в пивной банке
Анодом батарейки служит алюминиевый корпус банки из-под пива. Катодом – графитовый стержень.
- кусок пенопласта толщиной более 1 см;
- угольная крошка или пыль (можно применить то, что осталось от костра);
- вода и обычная поваренная соль;
- воск или парафин (можно использовать свечи).
От банки нужно отрезать верхнюю часть. Затем сделать кружок из пенопласта по размеру дна банки и вставить его внутрь, заранее сделав посередине отверстие для графитового стержня. Сам стержень вставляется в банку строго по центру, полость между ним и стенками заполняется угольной крошкой. Затем приготавливается водный раствор соли (на 500 мл воды 3 столовых ложки) и заливается в банку. Чтобы раствор не вылился, края банки заливаются воском или парафином.
Для подключения проводов к графитовым стержням можно использовать бельевые прищепки.
Область использования
Электрохимия имеет множество важных применений, особенно в промышленности. Ее процессы используются для изготовления электрических батарей. Они имеют множество применений, включая:
- Топливный элемент преобразует химическую потенциальную энергию, получаемую при окислении топлива, например, газа, водорода, углеводородов, спиртов в электрическую энергию.
- Различные виды пьезозажигалок для газа.
- Электрические приборы, такие как мобильные телефоны.
- Цифровые камеры-литиевые.
- Слуховые аппараты (оксидно-серебряные).
- Электронные часы (ртутные/оксидно-серебряные).
- Военные источники тока (тепловые).
- Батарейки A, AA, AAA, D, C и другие.
Использование химических реакций для производства электричества в настоящее время является приоритетом для многих исследователей. Возможность адекватно использовать химические реакции в качестве источника энергии в значительной степени поможет решить проблемы загрязнения окружающей среды.
Способ третий: медные монеты
Ингредиентами для изготовления такой батарейки своими руками являются:
- медные монеты;
- алюминиевая фольга;
- плотный картон;
- столовый уксус;
- провода.
Нетрудно догадаться, что электроды будут медные и алюминиевые, а в качестве электролита используется водный раствор уксусной кислоты.
Монеты для начала нужно очистить от окислов. Для этого их потребуется ненадолго опустить в уксус. Затем изготавливаем кружочки из картона и фольги по размеру монет, используя одну из них в качестве шаблона. Вырезаем кружки ножницами, картонные кладем на некоторое время в уксус: они должны пропитаться электролитом.
Затем из ингредиентов выкладываем столбик: сначала монету, затем – картонный кружок, кружок из фольги, снова монету и так далее, пока материал не иссякнет. Конечным элементом снова должна стать медная монета. К крайним монеткам можно заранее припаять провода. Если паять не хочется, то проводки прикладываются к ним, и вся конструкция плотно оборачивается скотчем.
В процессе работы этой батарейки, собранной своими руками, монеты придут в полную негодность, так что не стоит использовать нумизматический материал, представляющий культурную и материальную ценность.
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ: САМОДЕЛЬНАЯ БАТАРЕЯ
Каждому из нас знакомы химические источники тока различных типов и форм. Но как это часто случается, мы редко задумываемся о том, как устроен этот совершенно привычный и обыденный предмет. А между тем, появление первых химических источников тока, положило начало превращению электричества из лабораторной диковинки в нашего повседневного помощника.
Правильное объяснение этому явлению смог дать другой итальянский ученый Алессандро Вольта. Он установил, что это явление связано с наличием двух разнородных металлов, соприкасающихся с электролитом, в роли которого выступала кровь лягушки, а сама лапка играла лишь роль чувствительного индикатора электрического тока . Опираясь на свои исследования Вольта в 1799г. создал первый химический источник тока. В этом устройстве Вольта использовал медный и цинковый электроды, погруженные в раствор серной кислоты.
Цинк бурно реагирует с кислотами. В раствор переходят не атомы цинка, а положительные ионы, так что в электроде остается избыток электронов, следовательно, цинковая пластина заряжается отрицательно. Вообще, большинство металлов при погружении в электролит заряжается отрицательно, на поверхности медной пластинки протекает подобный процесс. Но избыток отрицательных зарядов на медном электроде гораздо меньше, а значит, относительно цинкового электрода его потенциал получается более высоким. Если соединить внешним проводником медную и цинковую пластины, то электроны начнут перемещаться с цинковой пластины на медную, т.е. в цепи потечет электрический ток .
Часто напряжения, даваемого одним гальваническим элементом, недостаточно. Тогда их можно соединять последовательно в батареи.
Вообще изготовить химический источник тока совсем нетрудно: надо поместить в электролит две пластинки из разных металлов . Такие гальванические элементы возникают самопроизвольно. Например, намочил дождь крышу, покрытую оцинкованным железом, на железе наверняка имеются царапины, так, что и железо, и цинк вступили в контакт с водой, которая играет роль электролита. Цинк в такой паре начнёт активно разрушаться, а вот железо не пострадает, пока не разрушится весь цинк. Именно для этого и покрывают железо слоем цинка.
Нагляднее всего можно пронаблюдать гальваническую коррозию на примере контактов железа с цинком и медью в растворе соли. Железные скрепки были надеты на цинковую и медную пластины и погружены в раствор соли.
Через сутки скрепка, соединенная с медной пластиной, покрылась ржавчиной. В то время, как скрепка, бывшая в контакте с цинком, совершенно не пострадала.
Ученые составили электрохимический ряд напряжений металлов. Чем дальше друг от друга отстоят металлы в этом ряду, тем более высокое напряжение дает гальванический элемент, составленный из этих металлов. Так пара золото – литий теоретически может дать электродвижущую силу (ЭДС) 4,72 В. Но такая пара в водной среде работать не сможет – литий это щелочной металл, легко реагирующий с водой, а золото стоит слишком дорого для подобного применения.
На практике элемент Вольта обладает рядом серьёзных недостатков.
- Во-первых, электролитом ему служит весьма едкая жидкость – раствор серной кислоты. Жидкий электролит всегда представляет собой неудобство или даже опасность. Он может расплескаться, разлиться при повреждении корпуса.
- Во-вторых, на медном электроде такого элемента будет выделяться водород. Это явление называется поляризацией. По многим свойствам водород весьма близок к металлам, так что его пузырьки создадут дополнительную ЭДС поляризации, стремящейся вызвать ток противоположного направления . Кроме того, пузырьки газа не пропускают электрический ток, что тоже ведет к ослаблению тока. Поэтому приходится периодически встряхивать сосуд, удаляя пузырьки механически, или вводя в состав электролита специальные деполяризаторы.
- В третьих, в процессе работы гальванического элемента Вольта, цинковый электрод постепенно растворяется. Теоретически, когда гальванический элемент не используют, разрушение цинкового электрода должно прекратиться, но поскольку почти всегда в составе цинка есть примеси других металлов, они при соприкосновении с электролитом играют роль второго электрода, образуя короткозамкнутый элемент, что ведет к гальванической коррозии цинкового электрода . Для того, чтобы устранить этот недостаток, приходится использовать сверхчистый цинк или конструктивно предусматривать возможность извлечения цинкового электрода из электролита. Так что когда батарея не используется, электролит из нее следует сливать.
Но для демонстрационных целей всеми этими недостатками можно пренебречь, если заменить серную кислоту более безопасным электролитом.
, нужно позвонить или еще что-то сделать. Так вот, давайте
сделаем батарейку
из того, что у нас имеется под рукой!
1. Батарейка из соляного раствора
Для изготовления гальванического элемента нам потребуется:
1) Большой сосуд (ведро, можно даже дырявое, или что-то в этом роде, можно даже полиэтиленовые пакеты) 2) Цинковую и медную пластину. Если нет пластин, то можно использовать и просто цинковую и медную проволоку, но пластины обладают большей площадью, и дают больший ток. 3) Земля. Да, можете взять и просто накопать земли. 4) Соляной раствор. Тут уж точных рекомендаций не дам. На ведро воды ну пол-пачки соли достаточно.
Все просто — засыпаем землю, втыкам электроды, поливаем, и на концах электродов вы увидите напряжение, порядка 0,5-1В. Конечно немного, но что вам мешает сделать батарею таких элементов? Для зарядки мобильника вполне хватит. Насыпали, залили и идете заниматься своими делами!
Хорошим вариантом самодельного элемента является воздушно-алюминиевый. Для этого нужно взять алюминиевую фольгу-катод,салфетку пропитать соленой (или морской водой), пробовал также брать кислый флюс, в качестве анода-горка угольного порошка,я брал тонер от картреджей лазерного принтера. Напряжение составляет 0.5-1.0в при токе 10мА
2. Батарейка из фруктов и овощей
Чтобы сделать гальванический элемент нам необходимо: два электрода, окислитель, восстановитель и электролит. Возьмем три пластинки: медную, железную и магниевую — они будут служить электродами. Чтобы измерить напряжение, нам необходим вольтметр, для этих целей вполне подойдет цифровой (или аналоговый) тестер. А в качестве «стакана» с электролитом мы используем большой и красивый… апельсин. Сок фруктов и овощей содержит растворенные электролиты — соли и органические кислоты. Их концентрация не очень высока, но нас это вполне устраивает.
Итак, положим апельсин на стол и воткнем в него три наших электрода (медный, железный и магниевый). К каждому из электродов предварительно прикрепите по проводку (для этого удобно пользоваться «крокодильчиками»). Теперь присоедините контакты тестера к медному и железному электроду. Прибор покажет напряжение около 0.4-0.5 В. Отсоедините контакт от железного электрода и подключите его к магниевому. Между медным и магниевым электродами возникнет разница потенциалов около 1.4-1.5 В — примерно как у «пальчиковой» батарейки. И наконец, гальванический элемент железо-магний даст напряжение около 0.8-0.9 В. Если поменять контакты местами, то показаниях прибора изменится знак («+» на «-» или наоборот). Другими словами, ток потечет через вольтметр в противоположном направлении.
Вместо апельсина можно использовать грейпфрут, яблоко, лимон, луковицу, картофель и многие другие фрукты и овощи. Любопытно, что батарейки из апельсина, яблока, грейпфрута и луковицы давали довольно близкие значения напряжения — разница не превышала 0.1 В. Восстановителем в нашем случае служит железо или магний, окислителем — ионы водорода и кислород (которые содержатся в соке). Обратите внимание, что железо в гальваническом элементе медь-железо заряжено отрицательно, а в элементе железо-магний — положительно. Если у вас нет магния, эксперимент можно провести и с двумя электродами — медным и железным. Вместо железа можно взять цинк или кусочек оцинкованной жести. Цинковый электрод должен дать большую разность потенциалов с медью и меньшую с магнием.
В случае цитрусовых, эксперимент выглядит особенно красиво, если разрезать плод поперек, так, чтобы были видны «дольки» и вставить в них электроды (обычно так разрезают лимон). Если плод разрезать вдоль, это будет выглядеть не так эффектно.
Приведенные цифры не следует воспринимать как абсолютные. Напряжение нашей батарейки зависит от концентрации ионов водорода (а также — других ионов) в соке фруктов и овощей, скорости диффузии кислорода, состояния поверхности электродов и других факторов. Напряжение сделанной вами батарейки может значительно отличатся от того, что наблюдалось в данном эксперименте. Можно соединить несколько фруктовых батареек последовательно — это увеличит напряжение пропорционально количеству взятых фруктов.
Для батарейки из картошки подойдут те же самые материалы, но она даёт меньше напряжения по этому рекомендуется внутрь картошки добавить немного соли, эффект будет намного больше.
3. Батарейка из кофе (Nespresso батарейка)
В попытке показать миру важность сбора и утилизации ценных алюминиевых материалов, дизайнеры Mischer ‘Traxler из Вены разработали аккумуляторы от 700 использованных алюминиевых баночек и кофейной гущи для питания кварцевых часов. Разработанную конструкцию назвали «Nespresso Battery», установка изготовлена из старых алюминиевых баночек, кофейной гущи, полосок из меди и соленой воды.
На фото снизу:
— часы, как испытательный прибор — соль — молотый кофе — провода — медные пластины — алюминиевые пластины — стакан — пластиковый разделитель из бутылки
В стакан кладём медную пластину (текстолит, монета, толстая проволока) и алюминиевую нарезку (из пивных банок). Чтобы медь с алюминием не соприкасались, ставим между ними разделитель из любого диэлектрика (пластик от бутылки, кофейная гуща), при этом он не должен мешать свободному протоку воды. К пластинам подсоединяем провода, один к медной и один к алюминиевой. Теперь возьмём воды и добавим туда несколько ложек соли, перемешаем их до полного растворения соли. Наливаем этот раствор в стакан. Всё батарейка сделана.
Каждая батарея производит достаточно энергии для электромеханических кварцевых часов. А 17-и батарей достаточно для работы небольшого радио. Устройство является одним из трех победителей в конкурсе, озаглавленном «Устойчивость дизайна».
Кофейная гуща тут чисто для антуража, и чтобы можно было дать красивое название. А так её функция может быть использована для разделения проводников, можно вовсе отказаться от кофейной гущи.
4. Багдадская батарейка(Парфянская батарейка)
Небольшой парфянский сосуд был найден в Хужут-Рабу, в окрестностях современного Багдада (ныне Ирак), некогда являвшегося частью западных территорий Большого Ирана. В июне 1936 г. возле Багдада прокладывали новую железную дорогу — и рабочие обнаружили древнее захоронение. В процессе последующих раскопок выяснилось, что оно принадлежит к парфянскому периоду (ок. 250 г. до н.э. — 250 г. н.э.).
Одна из находок представляла собой глиняный сосуд с «пробкой» из асфальта. Сквозь «пробку» проходил железный стержень. Внутри сосуда стержень был опущен в медный цилиндр. Впервые этот сосуд был описан немецким археологом Вильгельмом Кёнигом в 1938 г. — он посчитал его очень похожим на электрическую батарею, и опубликовал статью на эту тему в 1940 г.
По схожему принципу можно собрать свою батарейку. Берём «сосуд», который можно сделать из: глины, пластилина, бутылки, банки, стакана, вставляем в неё медную пластину закрученную в цилиндр, в этот цилиндр вставляем никелированный гвоздь. Эти пластина и гвоздь являются электродами, они должны немного выглядывать из банки. Для их закрепления в корпусе «сосуда» можно использовать: клей эпоксидный, пластилин, замазку для окон и т.д. Теперь надо сделать электролит. Он может быть щелочной или кислотный. Для щёлочи надо сделать концентрированный раствор из: вода + соль или вода + сода. Для кислотного подайдёт разбавленная уксусная, щавелевая кислота в воде или можно использовать сок цитрусовых.
Заливаем электролит внутрь банки и тщательно закупориваем «сосуд». Всё Багдадская батарейка готова.
При наполнении такой модели электролитом, она может давать напряжение. В целом, в зависимости от вида электролита, напряжение, даваемое «батарейкой», варьируется от 0,5 до 2 вольт.
К сожалению, в связи с уничтожением множества иранских литературных источников и библиотек во время вражеских вторжений на территорию Ирана на протяжении столетий, не сохранилось никаких письменных сообщений о том, для чего именно служили такие сосуды. Все, известное нам о них сегодня — это только догадки.
5. Солнечная батарея
Начитавшись в безграничных просторах интернета про самодельные солнечные элементы, я решил провести свои «эксперименты» в этой области. Я расскажу вам о самом простом способе изготовления солнечных батарей своими руками.
Для начала я решил определиться с элементной базой. Для солнечного элемента нам надо P-N переходы. Они есть в диодах и транзисторах. Решено было выбрать кремниевые транзисторы КТ801. Они выпускались в металлическом корпусе и поэтому их можно открыть не портя кристалл. Достаточно надавить пассатижами на крышку и она отломается.
Теперь разберёмся в параметрах. При среднем дневном освещении, каждый наш транзистор выдаёт 0.53В (База — плюс, а Коллектор и Эмиттер — минусы). А дальше идёт один нюанс. Транзисторы 1972 года выпуска имеет большой белый кристалл, и выдают около 1.1мА. Транзисторы с 1973 по 1980гг. выпуска имеют большой кристалл с зелёным покрытием, и выдают около 0.9мА. Транзисторы выпускаемые позже имеют маленькие кристаллы и выдают всего 0.13мА.
Для эксперимента я использовал батарею из двух параллельных цепочек по 4 транзистора. Под нагрузкой она выдавала около 1.8В, 2-2.5мА. Это довольно скромные параметры, зато как говорится «на халяву». Питать такой батарейкой можно китайские наручные часы, или зарядить аккумулятор и питать светодиод, жучок и др.
Для удобства крепления и измерений можно закрепить транзисторы на печатной плате как на рисунке ниже. Моё устройство выполнено навесным монтажом, так как это ускоряет сборку.
6. Монетно-энергетическая батарейка
Вроде бы конструкция стандартна, цинково-медные контакты и подсоленная вода, но тут интересна сама конструкция батарейки.
Нам понадобится:
— лоток для льда — монеты из меди/медного сплава — монеты из никеля/алюминиевой бронзы/цинка — скрепки — соль — вода — светодиод (для проверки)
Чтобы получить батарею, необходимо соединить монеты в электроды и залить их электролитом. В каждой ячейке лотка необходимо разместить две монеты из разных сплавов, например медную и никелевую. Далее соединяем последовательно все ячейки с помощью скрепки. Прижимая к одной стороне стенки медную монету, а с другой никелевую закрепляем их скрепкой. После этого в каждый лоток необходимо залить электролит: соль+вода. Обратите внимание на концы лотка, так как ячейки идут в два ряда то, с одной стороны нам надо их соединить, а с другой должно остаться без соединения. Теперь проверяем работоспособность батареи с помощью диода или мультиметра, для этого замыкаем им две не соединённые ячейки.
Одна ячейка производит электричество напряжением 0,5 в, а соединённые в одну батарею — 2 в и 110 мА. По этому желательно один электролит на все ячейки, а не разнородный.
Особенности:
1. Ячейка должна быть полностью залита электролитом, но контакт должен быть только с монетой, а не скрепкой. 2. Одна из пар ячеек не должна замыкаться между собой. 3. Цинковые монеты используются в качестве положительных электродов, а медные — отрицательные. 4. Монеты должны быть из разных металлов/сплавов (медь и никель), желательно так же отсутствие одинаковых примесей в сплавах.
7. Самодельный аккумулятор
Теперь мы изготовим достаточно простое устройство, а точнее источник питания — самодельный аккумулятор напряжения. Как известно, два разных металла погруженные в раствор электролита, способны в себе накапливать электрический ток. В качестве электродов было решено использовать медную и алюминиевую фольгу (на мой взгляд они самые доступные).
Кроме фольги нам еще понадобится — лист бумаги, прозрачный скотч и сам сосуд, в котором мы поместим банку аккумулятора (очень удобно использование стеклянного сосуда из — под нафтизина или валериановых таблеток).
Смотрим на фотографии.
Фольги почти одинакового размера, только алюминиевая фольга чуть длиннее, причины этому нет, просто на медную фольгу легче нанести припой, чем на алюминиевую и провод к фольге не припаян, просто свернут в нее затем зажат при помощи плоскогубцев.
Далее обе фольги были завернуты в лист бумаги. Не допустимо касание металлов друг к другу, между ними ограждением служит лист бумаги. Затем фольги нужно взять вместе и завернуть в кружок и обмотать ниткой или прозрачным скотчем.
Затем изготовленный сверток нужно поместить в сосуд. После этого берем 50 мл воды и разбавляем в нее 10 — 20 граммов соли. Раствор хорошенько перемешиваем и подогреваем до тех пор, пока вся соль не расплавится.
После расплавления соли раствор заливаем в сосуд, где у нас готовая заготовка для нашего самодельного аккумулятора. После заливки ждем несколько минут и измеряем напряжение на проводах аккумулятора. Забыл уточнить полярность аккумулятора, медная фольга — плюс питания, алюминиевая соответственно минус. Измерения покажут напряжение порядка 0,5-0,7 вольт. Но первоначальное напряжение ни о чем не говорит. Нужно зарядить наш аккумулятор. Заряжать можно от любого источника постоянного тока с напряжением 2,5-3 вольт, зарядка длится пол часа. После зарядки опять измеряем напряжение, оно возросло до 1,3 вольт и может достигать до 1,45 вольт. Максимальный ток такого самодельного аккумулятора может достигать до 350 миллиампер.
Можно изготовить несколько таких аккумуляторов и использовать как резервный источник питания скажем для светодиодной панели или фонаря. Для повышения мощности аккумулятора можно использовать фольгу больших размеров, но конечно такой самопальный аккумулятор держать заряд будет не очень долго (в течении одной недели заряд иссякнет), еще один минус — малый срок службы (не более 3 месяцев), поскольку на меди образуется оксид а во время процесса заряд-разряд алюминиевая фольга начинает поддаваться коррозии и постепенно разделится на мелкие кусочки, но думаю для экспериментов стоит попробовать собрать такой простенький аккумулятор.
8. Адаптер-переходник на постоянном токе
Имея немного свободного времени и желания, легко собрать из подручных материалов переходник-адаптер для питания различных гаджетов от внешнего источника питания. Что понравилось в данной статье, так это простота такого адаптера. Опишу подробнее технологию изготовления. Думаю, она окажется полезной кому-то ещё, тем более, что ничего сложно здесь нет абсолютно. За материалом даже никуда не ходил. Как раз на столе валялась старая карточка МТС. Не зря же сто рублей платил. Померил, в аккурат подходит для изготовления модели одного аккумулятора для фотика.
Раскройка картона:
Даже обрезков осталось совсем немного.
Картон, что и надо — жесткий, толщина где-то 0.25 мм. Сделал разметку и надрезал по швам. Картон не прорезал насквозь, а примерно чуть больше половины толщины, чтобы легче было сгибать и клеить. Для контактов расклепал медную проволоку 1.5 квадратных миллиметра. Получилось примерно так.
Так выглядят контакты изнутри:
Припаял провода и проклеил все швы на два раза клеем ПВА «Момент СТОЛЯР». Швы тоненькие, поэтому пришлось мазать кончиком зубочистки терпеливо, по капельке… Хотя, если кому не терпится, можно и скотчем склеить. Подключаем к «вампирчику» и работаем:
Подключил, всё заработало.
Пока обнаружилось только одно неудобство — провод. Толстый, тянется к фотоаппарату и к «вампирчику» Поэтому задумал пристроить к камере такой же аккумулятор, как в «вампирчике», только с защитой. Кстати, аккумуляторы с защитой здесь ставить не обязательно, т.к. фотоаппарат уже имеет встроенный измеритель уровня заряда и при разряде аккумулятора он просто не включится.
И не забывайте соблюдать полярность!!!
>
Случайные материалы сайта
Как правильно заточить нож 10138
Литиевая батарейка
Литий-марганцевая диоксид батарейка -это относительно недавняя разработка, использующая преимущества высокого электродного потенциала и плотности энергии металлического лития. Она предлагает значительно большую плотность энергии и емкость, чем “щелочная” и угольная, при относительно небольшом увеличении стоимости.
Литий находится в форме очень тонкой фольги и запрессован внутри банки из нержавеющей стали, чтобы сформировать отрицательный электрод.
Положительный электрод – диоксид марганца, смешанный с углеродом для улучшения его проводимости, а электролит-перхлорат лития растворен в пропиленкарбонате.
Номинальное напряжение на клеммах литиевого элемента составляет 3,0 в, что в два раза больше, чем у “щелочных” и других гальванических элементов. Он также имеет очень низкую скорость саморазряда, что дает ему очень длительный срок хранения. Внутреннее сопротивление также довольно низкое и остается таким в течение всего срока службы.
Литиевая батарея хорошо работает при низких температурах, даже ниже -60 °C, и передовые разработки используют их в спутниках связи, космических аппаратах, военных и медицинских приложениях. Медицинские приложения, требующие длительного срока службы критически важных устройств, таких как искусственные кардиостимуляторы и другие имплантируемые электронные медицинские устройства, используют специализированные литий-ионные батареи, которые могут работать в течение многих лет.
Литиевые гальванические элементы батарейки подходят для менее важных применений для работы с игрушками, часами и камерами. Хотя литиевые батареи стоят дороже, они обеспечивают более длительный срок службы, чем “щелочные” батареи, и сводят к минимуму их замену.
На практике, однако, напряжение на клеммах уменьшается по мере уменьшения заряда. Именно по этой причине, в отличие от вторичных батарей, первичные, как правило, не получают спецификации емкости ни в ампер-часах, ни в миллиампер-часах от большинства производителей вместо этого обычно задается только максимальный ток разряда. Литиевые гальванические элементы обладают значительно большей плотностью энергии и емкостью, чем “щелочные” и другие первичные батареи; они обеспечивают более высокое (примерно в два раза) напряжение на клеммах по сравнению с другими первичными элементами, и напряжение на клеммах остается почти постоянным в течение всего срока службы.
Причины дефектов покрытия
Существует несколько дефектов:
- Неравномерный блеск – слишком большая сила тока или низкая температура раствора.
- Отсутствие блеска – недостаточное количество серной кислоты или ангидрида.
- Появление коричневых пятен – недостаток серной кислоты или избыток хромового ангидрида.
- Низкая прочность покрытия – низкая сила тока или завышенная температура электролита.
Разновидности гальванических элементов
Самыми распространенными считают угольно-цинковые элементы. В них применяется пассивный угольный коллектор тока, контактирующий с анодом, в качестве которого выступает оксид марганца (4). Электролитом является хлорид аммония, применяемый в пастообразном виде.
Он не растекается, поэтому сам гальванический элемент называют сухим. Его особенностью является возможность «восстанавливаться» на протяжении работы, что позитивно отражается на продолжительности их эксплуатационного периода. Такие гальванические элементы имеют невысокую стоимость, но невысокую мощность. При понижении температуры они снижают свою эффективность, а при ее повышении происходит постепенное высыхание электролита.
Щелочные элементы предполагают использование раствора щелочи, поэтому имеют довольно много областей применения.
В литиевых элементах в качестве анода выступает активный металл, что позитивно отражается на сроке эксплуатации. Литий имеет отрицательный электродный потенциал, поэтому при небольших габаритах подобные элементы имеют максимальное номинальное напряжение. Среди недостатков подобных систем можно выделить высокую цену. Вскрытие литиевых источников тока является взрывоопасным.
Изготовление батарейки
При изготовлении демонстрационной батареи гальванических элементов будем использовать стандартную пару – медь и цинк. Медную фольгу можно найти в некоторых трансформаторах. В крайнем случае, можно сделать медный электрод из свернутой в спираль голой медной проволоки . Цинк можно добыть из разрядившихся солевых элементов питания, как правило, в них остается достаточно много металлического цинка даже, когда элемент непригоден к дальнейшему использованию. Вместо раствора кислоты, возьмем 10% раствор поваренной соли. В качестве емкости для электролита взяты пластиковые емкости от витаминов объемом примерно 50-100 мл.
В качестве контактов использованы винты, которые одновременно закрепляю электроды на крышке. При этом крайне желательно крепить медные электроды латунным винтом. Цинковую пластину можно без проблем крепить стальным винтом. Для герметизации под гайку подложена подходящая по размеру резиновая сантехническая прокладка.
Батарея из трех гальванических элементов позволяет питать светодиод.
Напряжение на одном элементе батареи составляет около 1 В.
Ток, отдаваемый в нагрузку, составляет около 0,23 мА
Такого тока достаточно для свечения светодиода. Однако на фотографии это свечение можно заметить, только если снимать при большой светочувствительности.
Такую батарею можно использовать в школе, например для выполнения лабораторной работы, по определению внутреннего сопротивления источника тока .
Оборудование для приготовления электролита
Для хранения химических реактивов и электролитов нужна стеклянная посуда с притертыми крышками.
Для приготовления электролитов необходимые вещества нужно отмерять с точностью до одного грамма. Для этого нужны соответствующие весы. Их можно приобрести или изготовить самостоятельно, используя в качестве гирек советские монетки, номинал которых точно соответствует массе.
Гальваника в домашних условиях – это и приготовление электролита из добытых непростым путем химических реактивов. Специализированные фирмы, торгующие такими высококачественными веществами, не редкость, но их деятельность подконтрольна, и работа с ними требует наличия специальных разрешительных документов даже для юридических лиц. Частным лицам опасные химические вещества не продают.
Устройство и принцип работы гальванического элемента
Металл, погруженный в раствор электролита, называется электродом.
Электроды — это система двух токопроводящих тел — проводников первого и второго рода.
К проводникам первого рода относятся металлы, сплавы, оксиды с металлической проводимостью, а также неметаллические материалы, в частности графит; носители заряда — электроны.
К проводникам второго рода относятся расплавы и растворы электролитов; носители заряда — ионы.
Устройство, состоящее из двух электродов, называется гальваническим элементом.
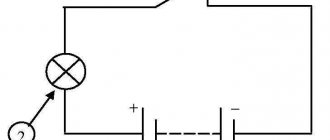
| Рис. 2. Схема медно-цинкового гальванического элемента |
Рассмотрим гальванический элемент Якоби—Даниэля (схема приведена на рис. 2). Он состоит из цинковой пластины, погруженной в раствор сульфата цинка, и медной пластины, погруженной в раствор сульфата меди. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой.
В гальваническом элементе электрод, сделанный из более активного металла, т.е. металла, расположенного левее в ряду напряжений, называют анодом, а электрод, сделанный из менее активного металла — катодом.
На поверхности цинкового электрода (анода) возникает двойной электрический слой и устанавливается равновесие:
Zn0 – 2ē ←→ Zn2+.
В результате протекания этого процесса возникает электродный потенциал цинка.
На поверхности медного электрода (катода) также возникает двойной электрический слой и устанавливается равновесие:
Cu2+ + 2ē ←→ Cu0.
В результате возникает электродный потенциал меди.
Так как потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, то при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди. В результате этого процесса равновесие на цинковом электроде смещается вправо, поэтому в раствор перейдет дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместится влево и произойдет разряд ионов меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы или не растворится весь цинк или не высадится на медном электроде вся медь.
Итак, при работе гальванического элемента Якоби—Даниэля протекают следующие процессы:
1. Анодный процесс, процесс окисления:
Zn0 – 2ē → Zn2+.
2. Катодный процесс, процесс восстановления:
Cu2+ + 2ē → Cu0.
3. Движение электронов во внешней цепи.
4. Движение ионов в растворе: анионов SO42– к аноду, катионов Cu2+ к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Суммируя электродные реакции, получим:
Zn + Cu2+ = Zn2+ + Cu.
В результате протекании данной реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т.е. электрический ток. Поэтому суммарную химическую реакцию, протекающую в гальваническом элементе, называют токообразующей реакцией.
Электрический ток в гальваническом элементе возникает за счет окислительно-восстановительной реакции, протекающей так, что окислительные и восстановительные процессы оказываются пространственно разделенными: на отрицательном электроде (аноде) происходит процесс окисления, на положительном электроде (катоде) — процесс восстановления.
Необходимым условием работы гальванического элемента является разность потенциалов электродов. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. Она равна разности между потенциалом катода и потенциалом анода элемента:
ЭДС = Eк – Ea . (1)
ЭДС элемента считается положительной, если токообразующая реакция в данном направлении протекает самопроизвольно. Положительной ЭДС отвечает и определенный порядок в записи схемы элемента: записанный слева электрод должен быть отрицательным. Например, схема элемента Якоби—Даниэля записывается в виде:
Zn │ ZnSO4 ║ CuSO4 │ Cu .
Основные методы хромирования
- Процесс химической металлизации.
- Гальванизация.
- Вакуумное напыление.
- Высокотемпературная диффузия.
Два последних метода применяются только на предприятиях промышленности. Дома эти процессы выполнить не получится, поскольку для них необходимы технически сложные установки и повышенные энергетические затраты. А вот химическая металлизация и гальванизация – это как раз те самые процессы, которые могут производиться и в личной мастерской. Рассмотрим подробно, как это делается.
В процессе этой работы используются химические реактивы, компрессор и краскопульт. Выполняются практически те же самые операции, что и при покраске поверхностей акриловым лаком либо эмалью. При хромировании таким способом на детали и конструкции наносится не защитная полимерная пленка, а зеркальный тонкий слой металла.
1-й метод. Поверхность покрывается специальными химикатами. В результате химической реакции образуется осадок, представляющий собой прочный металлический слой. Покрытие можно делать не только из хрома, но также из серебра.
2-й метод. В процессе восстановительной химической реакции из солей образуется слой хрома. Приготовьте набор из уксусной кислоты, хлористого хромила, хлористого хрома, уксуснокислого хрома, гипософита натрия, едкого натра, фосфата хрома. При этом необходимо помнить, что эти вещества очень ядовиты и опасны для здоровья.
И потому следует внимательно проштудировать учебник химии, если уж вы решили провести процесс хромирования этим методом. Но достичь высокого качества очень трудно, даже при наличии подробной инструкции. При всех существующих минусах этот метод используется для хромирования поверхностей в домашних мастерских чаще всего.
Очень удобно проводить процесс покрытия с помощью готовых пробных наборов химических препаратов для хромирования. Их предлагает компания Fusion Technologies. Удобство таких наборов заключается в том, что покрытие можно нанести на любой из перечисленных материалов: металл, керамику, дерево, стекло, пластик.
Получение бракованного покрытия не должно пугать начинающего гальваника. Некачественный слой хрома можно снять в растворе соляной кислоты (100-200 г/л). После этого детали промываются в воде, а процесс хромирования можно повторить.
Чаще всего встречается несколько основных дефектов:
- Отслаивание хромовой пленки. Главной причиной является плохая адгезия (сцепляемость) из-за недостаточного обезжиривания. После снятия покрытия поверхность заново очищается и активируется.
- Наросты (дендриты) хрома на острых краях и углах. Этот дефект свидетельствует о высокой плотности тока на острых гранях. Если можно, края лучше закруглить или установить экраны в проблемных зонах.
- Матовое покрытие. Чтобы добиться блеска, необходимо повысить температуру раствора, снизить силу тока или добавить хромовый ангидрид.
Гальванический элемент в домашних условиях
Простой источник тока можно сделать и своими руками. Для этого нам потребуется следующий инвентарь:
- Пластиковый стакан.
- Электролит. В качестве него можно взять соленый раствор, газировку или лимонную кислоту, разведенную в воде.
- Пластинки двух разных металлов. К примеру алюминий и медь.
- Провода
Процесс изготовления
Берем пластиковый стаканчик и наливаем в него электролит. Не следует наполнять стакан до самых краев. Лучше на 1-2 сантиметра не долить. К металлическим пластинам прикрепите проводники. Далее установите на края нашей емкости пластины из меди и алюминия. Они должны располагаться параллельно друг к другу. Когда все готова можно замерить с помощью вольтметра напряжение.
Подключите прибор и прикоснитесь щупами к контактам нашего источника тока. Держите и не отрывайте их пока на дисплее не высветится напряжение. Обычно оно составляет 0.5-0.7 вольт. Такие цифры показываются в зависимости от электролита. Точнее используемого вещества в его качестве.
Таким образом изготавливается самодельный гальванический элемент.
Гальванопластика и гальваностегия
Что такое гальванопластика? Это метод, который применяется для изготовления точных копий изделий, метод копирования. Его применяют, когда необходимо сделать копию с предметов тончайшей конфигурации – пластинок, чипов и схем. Гальваностегия позволяет усилить механические свойства одного металла путем нанесения на него слоя другого металла, например, хромирование и никелирование стали, никелирование меди и т.д.
Гальванопластика и гальваностегия имеют схожую природу, отличаются лишь способом подготовки металла перед обработкой. При осуществлении гальваностегии поверхность металла должна быть максимально подготовленной для сцепления с наносимым металлом. Метод гальванопластики, наоборот, подразумевает свободное отделение наносимого металла.
Для гальванопластических процессов применяют чаще всего медь, никель и серебро, а в гальваностегических – практически все виды металлов. Гальванопластика в домашних условиях проводится на том же оборудовании, что и другие гальванические процессы.
Под гальванопластическую ванну прекрасно подойдет большая стеклянная емкость.Её размеры зависят от величины гальванизируемого предмета, поскольку он не должен располагаться слишком близко от анодной пластины.
Гальванопластика дома может применяться для изготовления копий предметов небольшого размера по предварительно отлитым из легкоплавких металлов формам.
Мастер-класс по гальванике (1 видео)
Предметы с гальваническим покрытием (17 фото)
Схема гальванического элемента
Устройство гальванического элемента
Самый простой энергетический накопитель состоит из:
- Стрежня из угля.
- Двух разнородных металлов.
- Электролита.
- Смола или пластик.
- Изолятора.
Как видно из этой схемы в составе строения гальванического элемента имеется отрицательный и положительный электрод. Они могут быть выполнены из меди, цинка и других металлов. Имеют название по типу медно цинковые. Иногда их называют сухие батарейки.
Обозначение гальванического элемента на схеме выполнено в виде двух вертикальных прямых приближенных друг к другу на небольшом расстоянии. Одна из которых будет меньше. По краям возле каждой такой линии имеются знаки, обозначающие полярность. У длинной линии ставят плюс, а у короткой минус. Рядом может располагаться вольтаж. Это означает что схема в которой используется батарейка работает только от этого напряжения.
Принцип работы гальванического элемента
Работа гальванического элемента осуществляется за счет движения электронов от одного металлического контакта к другому. Идет некое химическое превращение. Подробнее про термодинамику гальванического элемента и образование гальванического электричества читайте здесь.
Ответы на часто задаваемые вопросы
| Гальванический/ая | Разъяснение |
| Батарея | Источник энергии работающий за счет процессов, происходящих в ограниченном миниатюрном пространстве. В частности, энергия появляется, когда идет химическая реакция. |
| Элемент Вольта или Вольтов столб | Это энергетический элемент впервые созданный ученым по фамилии Вольт. |
| Процесс | Взаимодействие между химическими элементами в результате которого образуется электрический ток. |
| Разряд | Это завершение протекания химической реакции. То есть взаимодействия между веществами не будет.Гальванический разряд есть в игре Warframe. По сути это модификация, которая находится в большом дефиците. Ее используют для холодного оружия. Полярность V2. |
| Гальванический контакт | Это контакт между электродами и раствором. |
| Эффект | Появление разности между двумя контактами из 2-х типов металлов. Величина зависит от температуры и химии проводников. По сути это первый закон Вольта. |
| Соединение/связь/цепь | Объединение 2-х и более участков электрической цепи с источником тока. |
| Гальванический заряд | Наполнение батареи энергией. |
Гальваника – это протекание химических процессов с использование электрического тока. В ходе реакция сокращается количество растворенных катионов металла до такой степени что в конечном итоге они создают единое покрытие на металлическом электроде. В итоге предмет получается более прочным, исчезают небольшие вмятины и его вид становится более привлекательным.
Общее представление о гальванике
Гальваническое покрытие может быть как технологическим, так и декоративно-защитным. Оно представляет собой тонкий поверхностный слой металла, обладающего хорошим эстетичным видом (золото, серебро) или антикоррозионными свойствами (цинк, медь) на металлических или пластмассовых изделиях.
В общих чертах гальваника металла в домашних условиях выглядит несложно.
Это интересно: Особенности сварки алюминия инвертором в домашних условиях